Дихлорметан – это хлорсодержащий органический растворитель, применяемый во многих сферах. Он проявляет хорошие растворяющие свойства, за счет чего способствует реакциям экстракции, очищает фрукты, овощи, используется для синтеза пластмасс и полимеров. Хлористый метилен – синтетический растворитель, токсичный при непосредственном контакте, поэтому при работе с ним необходимо соблюдать технику безопасности.
Содержание
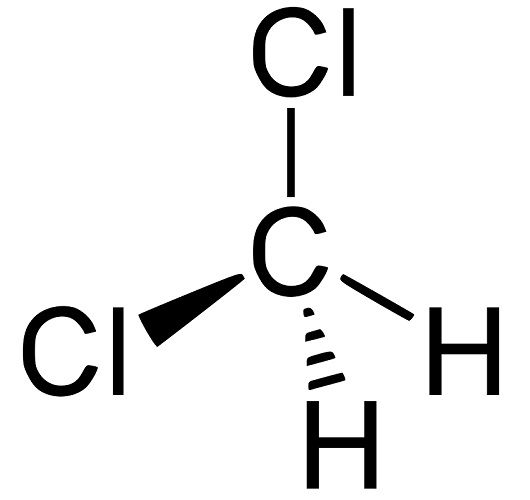
Что такое дихлорметан, формула
Дихлорметан представляет собой органическое галогенпроизводное, летучую жидкость со свойствами растворителя. Молекула имеет вид атома углерода, находящегося в центре, к которому прикреплено два водорода и хлористые радикалы. Рациональная формула дихлорметана:
CH2Cl2
Впервые он был выделен в 1840 году французским физиком и химиком Анри Виктором Рено путём смешивания хлорметана с газом хлора. В природе не встречается.
Формула дихлорметана показывает, что это алифатическое вещество, не включающее циклических ароматических компонентов. Оно относится к галогенпроизводным углеводородов, конкретно – метана. Рудничный газ – простейший алкан (CH4). Метиленхлорид – продукт замещения двух водородных атомов на хлоридные заместители.
Физические свойства, внешний вид
Дихлорметан – это жидкий растворитель без цвета, прозрачный, со слабым сладковатым запахом. Трудно воспламеняется, при контакте с водой даёт вспышку (14 °С), сам при этом не горит. Возгорается при смешивании с другими горючими растворами. Температура плавления отрицательная, составляет -96,7 °С, кипит при +39,8 °С. При достижении порога в 556 °С самовоспламеняется, при 450 °С – обугливается.
Свойство растворимости в воде слабо выражено, смешивается с ней тяжело, при подогревании процесс замедляется. Характерно формирование азеотропной смеси – жидкости, состав которой не изменяется при кипении. Смешивается со многими неполярными растворителями: спирты, ароматические циклы (бензол, толуол, фенол), эфиры, смолы. Обладает низкой плотностью и вязкостью, очень текуч. Устойчив к агрессивным воздействиям окружающей среды при невысоком уровне влажности.
Химические свойства и реакции с дихлорметаном
Дихлорметан вступает во взаимодействие с другими галогенами, хлорируется до образования хладона и паров хлороводорода:
CH2Cl2 + Cl2 = CHCl3 + HCl*
Реакция дихлорметана при 200 °С с йодом и бромом даёт йодиды и бромиды:
CH2Cl2 + I2 = CH2I2 + Cl2*
CH2Cl2 + Br2 = CH2Br + Cl2*
Растворитель подвергается восстановлению в присутствии палладиевого или никелевого катализатора:
CH2Cl2 + H2 = CH4 + CH3Cl
В формуле дихлорметана присутствует сильный окислитель, за счет которого идёт выделение карбонильных соединений (формальдегид) из оснований щелочных металлов:
CH2Cl2 + 2NaOH = CH2O + 2NaCl + H2O
При реагировании с аммиаком при показателе pH более 7 дихлорметан даёт амины – метанимин, а также хлорид натрия:
CH2Cl2 + NH3 + 2NaOH = CH3N + 2NaCl + 2H2O + NH3
Подвержен разложению при подогревании, при гидролизе выделяется альдегид и соляная кислота:
CH2Cl2 = CH2O + HCl
Другая реакция дихлорметана – Фриделя-Крафтса, введение алкильного заместителя в бензольный цикл:
CH2Cl2 + С6H6 + AlCl3 = C13H12
Производство и получение
В лабораторных условиях растворитель можно получить из трихлорметана и диметилкарбинола c добавлением карбонильного комплекса марганца при выдерживании нагрева до 120 °С в течение 3 часов:
CHCl3 + C3H8O + Mn2(CO)10 = CH2Cl2 + MnCl2 + CO2*
Возможно получение дихлорметана из хлороформа и гидроксида железа (II). Эти методики отличаются небольшим выходом – не более 73% продукта, поэтому не применимы для промышленного производства.
Для массового выпуска чаще всего используют метод радикального замещения при 500 °С, заключающийся в постепенной замене водородных частиц. Процесс ступенчатый, на одном из этапов происходит формирование метиленхлорида:
CH4 + Cl2 = CH3Cl
CH3Cl + Cl2 = CH2Cl2
Окончательная подмена идет до четырёххлористого углерода, задача производителя при этом состоит в недопущении полного протекания взаимодействия, чтобы повысить выделение хлорметилена.
Поскольку применение дихлорметана ориентировано на химическую сферу, важна степень итоговой чистоты. Очистку проводят промыванием концентрированными кислотами и щелочами, щадящую сушку и перегонку.
Применение
Основные области применения дихлорметана – химия, строительство, производство пластмасс, хроматография. Благодаря возможности смешивания с жирами и липидами, обезжиривает поверхности, помогает снять лакокрасочное покрытие.
Применение в пищевой промышленности
Применение дихлорметана для выпуска продуктов питания строго регламентируется, поскольку при приёме внутрь он токсичен. Не зарегистрирован в реестре добавок, т.к. используется в производственном процессе как экстрагент. Его можно найти в такой продукции:
- пиво;
- быстрорастворимые напитки;
- чай;
- кофе;
- искусственные и натуральные ароматизаторы.
Во время обработки кофейные зерна и чайные листья теряют часть кофеина, такие товары могут употреблять люди с повышенным давлением, которым противопоказан приём больших доз кофеиносодержащих напитков.
Применение в химии и других сферах
Формула дихлорметана делает его популярным в качестве реагента лабораторного синтеза. Невысокая реакционная способность позволяет растворять вещества без получения промежуточных нежелательных соединений.
Метилендихлорид разрушает пластмассы и каучуки, поэтому его наносят на пластиковые детали для точечного склеивания полистирола, полиэтилентерефталата. Такие свойства, как подвижность и летучесть обуславливают внесение его в состав аэрозолей и создание вспененного полиуретана. При добавлении метиленхлорида к полимерам он быстро испаряется, становится возможным изготовление быстро застывающих форм.
Другие области использования:
- Для получения ацетилцеллюлозы, необходимого для защитных плёнок на фотографии.
- В выработке лекарственных препаратов: антибиотиков, витаминов, нестероидных противовоспалительных средств.
- При изготовлении электронных печатных плат как обезжириватель алюминия.
- За счет вспыхивающих свойств добавляется в жидкость для новогодних огней.
Где купить и сколько стоит
Дихлорметан продаётся заводами-производителями, а также специализированными магазинами. Стоимость от 50 рублей за 1 л. Зарубежные компании импортируют его за 100 руб/л.
Заключение
Дихлорметан – это хлорсодержащее галогенпроизводное, применяемое как растворитель многих веществ, обезжириватель. При пероральном употреблении и вдыхании он токсичен, при обработке пищи используется как промежуточная экстрагирующая добавка. Способ получения – ступенчатое замещение. Необходим в фармацевтике, хроматографии, пластмассовой промышленности.
Читайте также:















Оставить комментарий