Галогеналканы – это соединение предельного углеводородного радикала с галогенами — йодом, бромом, хлором и фтором. Эти соединения используются в разных отраслях. В медицине, химическом производстве органических соединений, синтезе пластиков и даже в холодильной промышленности не обходится без участия галогеналканов.
Содержание
Что такое галогеналканы, формулы, виды
Галогеналканы — это соединения на основе алканового радикала и одного или нескольких (обычно не более двух-трёх) ионов галогена. Галогеналканы представляют собой углеводородную цепочку, прямую, циклическую или разветвлённую, в различных местах которой на месте одной или нескольких углеводородных присутствует соединение с атомом галогена. Галогеналканы принято разделять в первую очередь по виду галогена, с помощью которого они образованы:
- хлоралканы;
- фторалканы;
- бромалканы;
- йодалканы.
Именно это их различие играет наибольшую роль в химических или физических свойствах галогеналканов. Также встречаются алканы смешанного типа, например, фторхлорметан.
Формула молекулы галогеналкана с прямой цепочкой имеет вид:
CnH2n+2-kHalk, где k — количество атомов галогена.
Формула любого другого соединения брутто будет иметь аналогичный вид алкана, на основе которого она сформирована, с той лишь разницей, что атомов водорода в ней будет на k единиц меньше, а атомов галогена — на k единиц больше. Как уже говорилось, k обычно принимает значение не более трёх.
Изомерия и номенклатура галогеналканов, формулы
Стоит прежде всего определиться с тем, какое строение имеет молекула галогеналкана, как она при этом будет называться и чем будет отличаться структурная формула и брутто-формула.
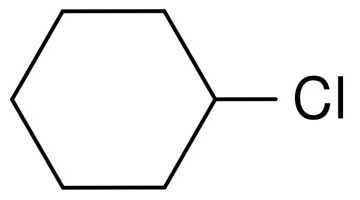
Например, вот структурная формула хлорциклогексана:
Брутто-формула этого галогеналкана выглядит так: C6H11Cl.
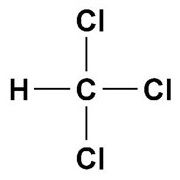
Вот другой галогеналкан – хлороформ, или метил-3-хлорид:
Его брутто-формула CHCl3.
Вот 2-хлорбутан:
Брутто-формула 2-хлорбутана C4H9Cl.
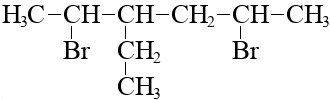
А вот 3-этил-2,5-бромгексан:
Его брутто-формула C8H16Br2.
Для циклоалканов наименование указывает то, на каких местах находятся атомы галогена в молекуле предельного циклорадикала, в основном это радикал на основе циклогексана. Атомы галогена при выборе наименования соединения имеют самый низкий приоритет: ниже, чем функциональная группа, связи с кратностью или же углеводородный радикал:
На этом примере можно видеть молекулу 3-метил-6-хлоргептана. Здесь нумерация идёт ближе к тому концу, где самый определяющий свойства и структуру элемент, здесь это метиловый радикал на третьем месте цепочки. И затем идут дальше к концу, встречают на шестом месте хлор и включают в наименование.
Кроме традиции наименования «хлоргептан», «хлорметил», существует и другая. Она применяется в отечественной литературе. Например, уже было использовано наименование метил-3-хлорид, соединение, где три водородных связи замещены молекулами хлора. Оно полностью аналогично наименованию «трихлорметил», однако в данном случае уместнее говорить «метил-3-хлорид», поскольку здесь речь идёт о именно трёх водородных связях на одном углеродном участке. В случае более сложной молекулы принято говорить «2-дихлор» или «4-трихлор», если на одном участке цепи находятся несколько атомов галогена. На письме «дихлор» и «трихлор» пишутся не цифрами, а словами, чтобы не вносить путаницу в структуру молекулы.
Стоит сразу же сказать о структурных изомерах — веществах, имеющих одну и ту же брутто-формулу, но разное строение молекулы. Как известно, алканы, а также парафины, часто представлены в виде различных структурных изомеров. Например, 2-метилгептан и 3-метилгептан имеют абсолютно одинаковую брутто-формулу, но разное строение молекулы. В первом случае молекула метилового радикала находится на втором месте, а в следующем — на третьем. При этом оба будут иметь брутто-формулу C8H18.
Точно такую же формулу будет иметь и любое другое предельное углеводородное соединение нециклического типа в зависимости от числа атомов углерода — CnH2n+2. Вне зависимости от строения, структуры. Единственная эта формула охватывает огромное разнообразие молекул. Циклическая молекула будет иметь формулу несколько другую, CnH2n.
В галогеналканах на места некоторых атомов водородов добавляются атомы фтора, хлора, брома или йода. Или же с разными галогенными радикалами. Брутто-формула такого структурного соединения будет иметь вид CnH2n+2-kHalk для нециклических и CnH2n-kHalk для циклических соединений. Здесь и далее Hal — это один или несколько галогенов.
Кроме структурных изомеров, существуют также стереомеры, или оптические изомеры. Их структурная формула будет точно такой же, как и у своих стереогомологов. Однако по факту химические свойства могут немного отличаться. Всё дело в том, что в пространстве данные молекулы могут иметь совершенно разное расположение своих атомов — благодаря структуре углеродной связи. И возможно различное положение их из-за разных вариантов, как молекула углерода может располагаться в данной связи. Обычно стереоизомеры появляются там, где существует ветвление молекулы с присоединением углеводородного радикала и галогена, и таких стереоизомеров может быть две штуки.
Физические свойства галогеналканов
Физические свойства галогеналканов достаточно интересны. Именно благодаря им они имеют своё практическое применение. Благодаря тому, что радикалы галогенов обладают большой молярной массой, молекулы галогеналканов чаще встречаются в виде жидкостей, чем производные молекулы простых алканов.
Например, один из галогеналканов – вещество хлороформ, рассмотренное ранее, трихлорметан, имеет в обычных условиях свойства летучей жидкости, в то время как метан, на основе которого она была образована, имеет газообразную форму в тех же условиях. При этом галогеналканы имеют температуру кипения, которая позволяет использовать их в холодильном оборудовании, близкую к нулю градусов по Цельсию. Например, трифторйодметан имеет температуру кипения -24°C. Удельная теплоёмкость и теплопроводность этих веществ также достаточно велика.
Отсюда общее название некоторых этих веществ — хладоны, или фреоны. Да-да, именно этим веществом заполнены трубки холодильника у вас на кухне. В чистом виде эти вещества в системах охлаждения применяются редко, чаще используют смесь из разных веществ. Обычно хладонами называют галогеналканы, основанием которых является метан или этан, реже – пропан. Более крупные молекулы, например, 2-хлоргептан, уже будут находиться в обычных условиях в жидком виде. И это не позволяет использовать их для охлаждения. Для охлаждения используют те галогеналканы, где на одном атоме углерода находятся два или три атома галогена — именно они имеют необходимые свойства, сниженную температуру плавления и кипения.
Другие физические свойства галогеналканов:
- Низкомолекулярные не горят, не воспламеняются даже при испарении на открытом воздухе. Высокомолекулярные уже горят.
- Не имеют цвета. Исключение — йодалканы, которым выделяющийся йод может придавать красноватую окраску.
- Галогеналканы на основе низкомолекулярных соединений метана и этана имеют сладковатый запах, прочие — не имеют запаха;
- Имеют более высокую плотность, чем их алкановые аналоги без присутствия атомов галогенов.
Химические свойства галогеналканов, реакции с галогеналканы, их соединения и взаимодействия
Химические свойства галогеналканов обусловлены строением их молекул. Прежде всего, галоненовый радикал обладает сильной электроотрицательностью, и оттягивает электронное облако в свою сторону. При этом молекулы на основе фтора получаются более компактными, а молекулы на основе йода — более «рыхлыми». Именно это свойство фтора позволяет молекуле становится более плотной и проявлять нужные для использования в охлаждении свойства.
В основном, реакции с галогеналканами проходят по следующим схемам:
- Замещение галогенового радикала — реакции нуклеофильного замещения;
- Реакции нуклеофильного расщепления, элиминирование;
- Образование металлорганических соединений с цинком и магнием;
- Некоторые поддерживаю реакцию окисления — в основном высокомолекулярные соединения.
Замещение атома галогена в галогеналкане происходит при синтезировании различных спиртов:
CH3Cl + NaOH = CH3OH + NaCl;
В реакциях с галогеналканами с образованием соединений аммония:
CH3Cl + NH4 = CH3NH3 + HCl;
А также в реакции Фиделя-Крафтса:
Нуклеофильное расщепление происходит с образованием непредельного углеводородного соединения и выделением галогенопроизводной кислоты или её соли, с образованием алкина, а также с неполным замещением атома галогена:
Монорасщепление:
CH3CH2Br = CH2CH2 + HBr;
Расщепление при участии второго реагента:
CH3CH2CHBrCH3 + KOH = CH3CHCHCH3 + KBr + H2O;
Реакция с галогеналканами образования металлорганического соединения с цинком:
CH3CH2I + 2Zn + CH3CH2I = CH3CH2ZnCH2CH3 + ZnI2.
Несколько особняком здесь стоит реакция Вюртца, при которой изменяется структура молекулы исходного алканового соединения:
Производство и получение галогеналканов, уравнения
Рассмотрим получение галогеналканов разных видов.
Производство фторалканов происходит на основе алкенов при помощи реакции присоединения к ним фторидов или фторводорода:
CH2CH2+HF = CH3CH2F
Производство хлоралканов основано на взаимодействии алкинов с соляной кислотой и хлором, спиртов с хлором и хлорировании сероуглерода:
2CH4 + Cl2 = 2CH3Cl + H2;
CH3OH + HCl = CH3Cl + H2O;
CS2 + 2Cl2 = CCl4 + 2S
Производство бромалканов основано на замещении атома водорода в алкене или алкане на атом брома при реакции с бромводородом:
RCHCH2 + HBr = RCH2CH2Br
Йодалканы производят при взаимодействии спиртов с йодом и красным фосфором по типу реакции, описанной ранее для хлоралканов.
Применение галогеналканов
Основное применение хлоралканов – это использование их в качестве хладоагентов. Часть галогеналканов используется при производстве виниловых пластиков — например, полихлорвинила. Этот пластик идёт на изготовление резиновой обуви, надувных лодок, обоев и линолеума. Некоторая часть галогеналканов используется в химической промышленности при производстве бензойных соединений.
Заключение
Галогеналканы – это простые по своей структуре соединения, однако они обладают массой интересных свойств. Почти каждый из нас пользуются ими ежедневно, открывая дверцу холодильника или надевая куртку из винилового волокна, лёгкую и отталкивающую воду. Кроме описанных выше реакций с ними, существует и ряд других интересных реакций с ними, например, реакция Вюртца имеет более сложную природу, если углубляться в её изучение. Во время исследований галогеналканов были открыты многие химические законы, например, правило Марковникова.
Читайте также:


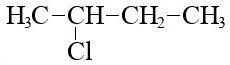
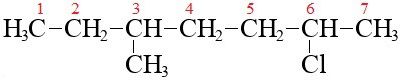
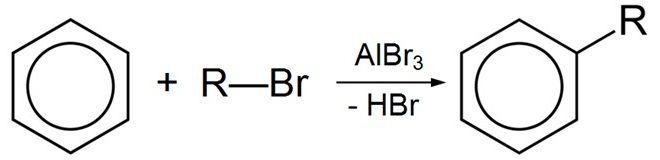
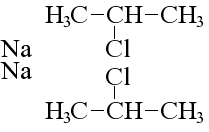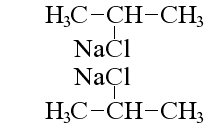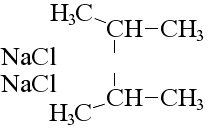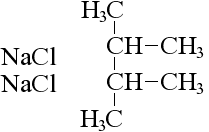













Оставить комментарий