Хлорид алюминия – это неорганическое соединение, состоящее из алюминия и присоединённых к нему атомов хлора. Данное вещество активно используется во всех сферах, химическая промышленность – область, потребляющая большинство производимого хлорида алюминия. Его высокая активность обуславливает применение хлорида алюминия в качестве катализатора, компонента, образующего аддукты, в металлорганическом синтезе.
Содержание
Что такое хлорид алюминия, формула
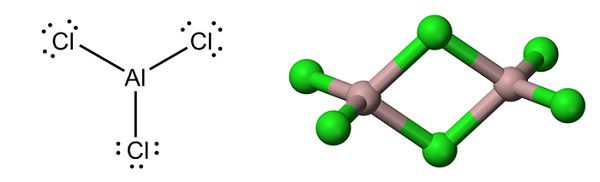
Хлорид алюминия представляет собой соль неорганического происхождения, представлена остатком соляной кислоты и парамагнитного металла алюминия. Атом алюминия имеет валентность, равную трём, т.е. он потенциально может создавать три связи за счёт свободных электронов, при этом он обладает амфотерностью: способен реагировать как с металлами, так и с неметаллами. Формула – AlCl3.
В природе безводный хлористый алюминий не встречается, он синтетический. Обводнённый хлорид можно найти в составе кадваладерита. Это редко встречающийся минерал, состоящий из зеленоватых мелкодисперсных кристаллов, собранных в аморфные корочки на поверхности горных пород. Хлорид алюминия можно встретить в виде хлоралюминита – бесцветных наростов вблизи вулканов, которые проявляют стеклянный блеск, кристаллики призматические, прозрачные.
Физические свойства, внешний вид
Хлорид алюминия — это белый или зеленовато-желтоватый мелкокристаллический порошок, с плотностью порядка 2,48 г/см3, без вкуса и запаха. Жёлтый оттенок появляется за счёт железосодержащих примесей. Может прибывать в трёх состояниях:
- твёрдое – листообразные кристаллы, в пространственной структуре которой алюминий занимает центральное положение, а хлор со всех сторон плотно упакован в кубы;
- жидкое – бесцветный раствор;
- газообразное – газ, лишённый аромата и цвета.
Очень гигроскопичен и быстро поглощает влагу, преобразуясь в кристаллогидраты, которые отличаются по свойствам. Ангидрид хорошо растворим в полярных растворителях: вода, ацетон, спирт (метанол и этанол), эфиры. При подогревании растворимость возрастает. Плохо растворяется в бензоле (но лучше – в нитробензоле) и толуоле. Раствор хлорида алюминия кислый, т. к. значение водородного показателя менее 7.
На открытом воздухе хлорид алюминия дымится, выделяются пары хлороводорода. Плавится при достижении температурного режима в 193 °С. Гексагидрат закипает при 120 °С. Возгонка при температуре 183 °.
Химические свойства, реакции
Хлористый алюминий вступает во взаимодействия с разными типами веществ. Так, хлорид алюминия реагирует с едкой щёлочью, при этом выпадает белый осадок гидроксида алюминия:
AlCl3 + 3NaOH → 3NaCl + Al(OH)3↓
Другой вариант ионного обмена – реакция с ортофосфатом натрия, в результате которой выделяется фосфат алюминия:
AlCl3 + Na3PO4 → AlPO4↓ + 3NaCl
При действии на порошок концентрированным едким натром, образуется комплексная соль сложного состава – тетрагидроксоалюмината:
AlCl3 + NaOH → Na[Al(OH)4] + 3 NaCl
Раствор хлорида алюминия реагирует с карбонатами, продукты реакции необратимо гидролизуются:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 6NaCl
Хлорид алюминия реагирует с серной кислотой при подогревании:
AlCl3 + H2SO4 → Al2(SO4)3 + 6Hl↑
Алюминий вытесняется из хлорида более сильными металлами, реагирование алюминия хлорида с выпадением чистого алюминия описывается уравнением:
AlCl3 + 3Na → 3NaCl + Al↓
Хлорид алюминия реагирует с гидридами, формируются алюмигидриды:
AlCl3 + 4NaH → NaAlH4 + 3NaCl
При пропускании через раствор хлорида электрического тока происходит электролиз, сопровождающийся выделением смеси газообразного хлора и водорода:
2AlCl3 + 6H2O → 3Cl2↑ + 2Al(OH)3 + 3H2↑
Хлорид алюминия реагирует с гидроксокомплексами:
AlCl3 + 3K[Al(OH)4] → 4Al(OH)3↓ +3KCl
Через расплав также возможен пропуск электричества, он разлагается на соответствующие компоненты:
2AlCl3 → 2Al↓ + 3Cl↑
Гидролиз (разложение водой) протекает ступенчато и частично, по катиону. Выделяется избыточное количество протонов водорода.
AlCl3 → AlOHCl2 + H+ + Cl–
Производство и получение хлорида алюминия
В лабораторных условиях получение идёт несколькими путями. Чаще всего для этого нейтрализуют кислоту гидроксидом:
3HCl + Al(OH)3 → AlCl3 + 3H2O
Для получения могут применять другие методики:
- обработка карбидов хлороводородом: Al4C3 + 12HCl → 4AlCl3 + 3CH4↑;
- выделение из смешанного окисла: KAlO2 + 4HCl → AlCl3 + KCl + 2H2O;
- непосредственное получение из алюминия: 2Al + 6HCl → 2AlCl3 + 3H2↑.
В промышленности основной метод производства хлорида алюминия заключается в обработке обезвоженной белой глины или алюминиевой руды газообразным хлором и угарным газом в специализированных шахтных печах:
Al2O3 + 3CO + 3Cl2 → 2AlCl3 + 3CO2↑
Применение
Хлорид алюминия используется в основном в химических отраслях. Он необходим для обработки древесины, многих аналитических реакций, незаменим на водоочистных сооружениях, для выпуска косметических гигиенических средств. Хлорид алюминия востребован в нефтеобработке.
Применение хлорида алюминия в химии
Хлорид алюминия – компонент множества реакций органики и неорганики, а также аналитики. Его растворы – это качественные реагенты для получения многих ценных соединений. Трихлоралюминий – акцептор электронных пар, образующий кислотно-основные аддукты. Адууктом называется продукт объединения двух веществ. В связи с этим он участвует в различных сложным реакциях, в частности Фриделя – Крафтса, которые требуют наличия в среде кислотных катализаторов:
- Алкилирование – введение алкильного радикала (частицы алкана с одним свободным электроном: этил, метил, бутил и т. д.) в структуру. Таким образом получают антрахинон – слабое слабительное и краситель, а также моющие средства, поверхностно-активные вещества (ПАВ), этилбензол – растворитель бензинов.
- Ацилирование – добавление ацильного радикала (ацила – частица, имеющая в альфа-положении карбоксильную группу: формил, ацетил, бутирил) в молекулу через замещение водородного атома. В результате реакций получают амиды, эфиры, ароматические вещества, кетоны.
Нефтеперерабатывающая промышленность использует хлорид алюминия в качестве деструктивного катализатора при вторичной переработке нефти и тяжёлых нефтепродуктов. Применение заключается в разогревании нефти с трихлоралюминием, происходит её разложение на фракции, в итоге выделяются бензиновые углеводороды.
Хлорид алюминия – это коагулянт, применяемый для очистки сточных и питьевых вод. Он связывает частицы загрязнений в крупные конгломераты, задерживаемые фильтрами.
Применение хлорида алюминия в косметике
В косметологии хлористый алюминий вносят в состав антиперспирантов. Он закупоривает поры подмышечных впадин, не позволяя выделяться поту и неприятному запаху. Вещество выполняет функцию стабилизатора и эмульгатора, смешивая жидкие и твёрдые фазы в средствах по уходу за кожей. Хлорид алюминия можно обнаружить в таких товарах, как:
- дезодоранты;
- пудра;
- кремовая пудра;
- крем для лица и рук.
Меры предосторожности, токсичность
Хлорид алюминия относится к 8 классу опасности – вещество, вызывающее коррозию. При работе с ним необходимо соблюдать технику безопасности: надевать защитный костюм, перчатки и респиратор. При вдыхании порошка раздражает слизистую дыхательных путей, при попадании на кожу – оставляет ожоги, провоцирует зуд и покраснение.
Упаковка, транспортировка
Хлорид алюминия упаковывают в комбинированную тару: термоусадочные ёмкости укладывают в картонные коробки, обёрнутые полиэтиленом. Транспортируют всеми видами крытого транспорта, но с осторожностью, поскольку это опасный груз.
Где купить и сколько стоит
Хлорид алюминия продают заводы-производители оптом. Стоимость зависит от степени чистоты, низкой очистки порядка 40 р/кг, более высокой – от 200 рублей, особо чистый – от 4000 рублей за 1 кг. Минимальная закупка, как правило, от 25 кг.
Заключение
Хлорид алюминия – это порошкообразное вещество, легко впитывающее влагу. Он ускоряет реакции, способствует расслоению нефти, действует как флокулянт при очищении воды, применяется в деревообрабатывающей промышленности и косметологии.
Читайте также:















Оставить комментарий