Азотная кислота — это сильная неорганическая гидроксид-кислота, которая востребована во всех сферах промышленности. Её используют в качестве реактива для получения взрывчатых веществ, аммонийных удобрений, лекарственных средств. Раствор азотной кислоты необходим для изготовления пластмасс, проявления фотографий, создания красящих составов, фунгицидов, промывки труб и теплообменников.
Содержание
Что такое азотная кислота, формула, виды
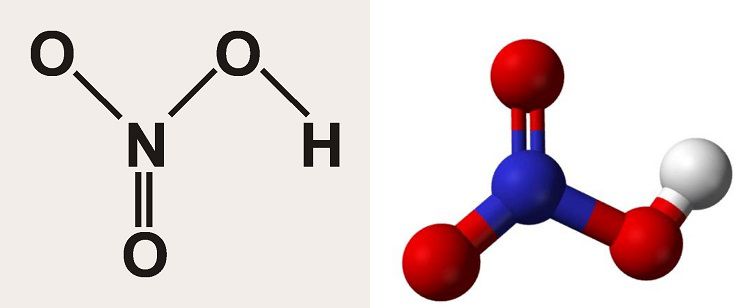
Концентрированная азотная кислота представляет собой вещество, состоящее из водорода и кислотного остатка. Химическая формула – HNO3. Чистая азотная кислота в естественных условиях не встречается, однако её находят в смеси с другими веществами (селитра). Первые способы синтеза раствора азотной кислоты возникли в 8 веке. В дальнейшем методика модифицировалась и усложнялась.
Различают два вида азотной кислоты, которые характеризуются разной степенью выраженности химических характеристик и зависят от насыщенности раствора кислотой:
- концентрированная азотная кислота – проявляет свойства сильнейшего окислителя;
- разбавленная азотная кислота – реагирует как типичная сильная кислота.
Концентрированная азотная кислота, как правило, имеет коричневатый цвет, т.к. в ней присутствует оксид азота. На рынке азотная кислота существует в двух разновидностях: марка «А» пригодна для обработки электротехники, радиотехники, металлов, а также для выпуска препаратов и пластмасс. Марка «Б» наиболее распространена как растворитель, в процессах нитрования, в гальванике.
Физические свойства, внешний вид
При нормальных условиях азотная кислота — это жидкость без цвета, которая дымится на воздухе. Эффект дымления вызван тем, что она постепенно испаряется и формирует с влагой из воздуха мелкие капли тумана. Соединение неустойчиво по отношению к перепаду температур, свету, повышенной влажности. Под действием яркого освещения постепенно разлагается. Температура плавления отрицательна, достигает -41,59 °С. Раствор азотной кислоты закипает при +82,6 °С. Термолиз начинается при повышении температурного режима до +260 °С.
Свойство азотной кислоты хорошо растворяться в воде обуславливает азеотропную смесь – смешение двух жидкостей, при кипячении не изменяющий своего состава. Вещество гигроскопично, способно образовывать кристаллогидраты с соответствующими формулами:
- HNO3 ∙ H2O;
- HNO3 ∙ 3H2O.
Концентрированная азотная кислота может существовать и в твёрдой форме: в виде мелких ромбических беловатых либо бесцветных кристаллов.
Химические свойства, реакции
Азотная кислота вступает в характерные для кислот реакции из-за определённых свойств. Так, с натриевым гидроксидом кислота азотная даёт нитрат и воду:
HNO3 + NaOH → NaNO3 + H2O
Реакция кислоты азотной и окисления металлов демонтирует уравнение азотной кислоты с натрием:
HNO3 + Na → 8NaNO3 + N2O↑ + 5H2O
В реакции кислоты азотной с аммиаком происходит формирование аммонийной селитры:
HNO3 + NH3 → NH4NO3
Уравнение азотной кислоты показывает, как при попадании прямых солнечных лучей и подогревании запускается разложение:
4HNO3 → 4NO2↑ + O2↑ + 2H2O
В ходе взаимодействия выделяется неприятный на запах бурый газ. Вступает раствор азотной кислоты в реакции с основными оксидами, которые протекают по схожему со щелочами механизму:
2HNO3 + Na2O → 2NaNO3 + H2O
Разбавленный раствор азотной кислоты проявляет себя по-другому в реакциях кислоты азотной с металлами, в результате выделяется молекулярный азот:
12HNO3 + Na → 10NaNO3 + N2↑ + 6H2O
С гидроксидом кислота азотная приводит к формированию азотнокислого алюминия:
3HNO3 + Al(OH)3 → Al(NO3)2 + 3H2O
Раствор концентрированной азотной кислоты, в которой содержится оксид азота, окисляет сернистый газ:
HNO3 + SO2↑ → H2SO4 + 2NO↑
Уравнение азотной кислоты в реакции с сульфитом натрия в качестве продукта демонстрирует выделение сульфата и диоксид азота:
HNO3 + Na2SO3 → Na2SO4 + 2NO2↑ + H2O
Производство и получение, уравнение
В лабораторных условиях получение азотной кислоты ведётся путём диспропорционирования в водной среде:
2NO2 + H2O → HNO3 + HNO2
Также в лаборатории синтез азотной кислоты производят путём внесения пероксида водорода к азотистой кислоте:
HNO2 + H2O2 → HNO3 + H2O
В промышленности азотную кислоту добывают в процессе Оствальда, который включает несколько этапов. Они описываются экзотермическими реакциями (с выделением тепла) между нитрозными оксидами, которые завершаются выделением азотной кислоты:
- Окисление аммиака:
4NH3 + 5O2 → 4NO↑ + 6H2O - Оксид азота (II) окисляется до оксида азота (IV):
2NO + O2 → 2NO2↑ - Оксид азота (IV) поглощает вода при обилии O2
4NO2 + O2 + 2H2O → 4HNO3
Применение азотной кислоты
Применение азотной кислоты распространено в различных областях. Наибольшее потребление всей производимой азотной кислоты приходится на сферу химии. Посредством реагента здесь добываются различные органические производные: сложные эфиры, ароматические амины. Вещество распространено как исходный продукт для применения средств сельского хозяйства для предпосевной обработки почвы и избавления от грибковых заболеваний. Как очиститель азотная кислота востребована в ювелирном деле, в пищевой отрасли.
Применение азотной кислоты в фармацевтике и садоводстве
Азотная кислота важна для фармацевтической промышленности, поскольку с её помощью получают нитроглицерин путём смешивания глицерина со смесью азотной и серной кислоты. Нитроглицерин —лекарственный препарат, необходимый для расслабления гладкой мускулатуры кровеносных сосудов. Этот вазодилататор назначают пациентам со стенокардией, он купирует острый приступ, уменьшая боль и вероятность возникновения инфаркта миокарда.
Актуально применение кислоты для создания азотных удобрений. Их вносят в почву при пониженном содержании азота. Растения азотном голодании желтеют, теряют тургор, страдает плодоношение и цветение. Внесение удобрения позволяет улучшить вкусовые качества плодов и повысить декоративность культур. Данная кислота является основой для противогрибковых средств, направленных на борьбу с серой и чёрной гнилью, фитофторозом, паршой.
Применение азотной кислоты в лакокрасочной промышленности и других сферах
Азотная кислота эффективна для создания органических красителей. Её применяют для получения взрывчатки, тротила, отравляющего вещества. Важна её дымящая функция и токсичность для человека, что используется при проектировании боевого оружия. Едкость азотной кислоты выгодно применима в травлении форм для станковой графики.
Азотная кислота – это реактив для получения многих соединений. Так, она требуется для выработки нитроалканов – качественных растворителей, топлива реактивных двигателей. Применение кислоты также распространяется на выпуск сырья для бездымного пороха – нитроцеллюлозы.
В фотографии сегодня азотная кислота используется реже, поскольку на смену плёнкам пришли цифровые изображения и из-за её агрессивных свойств. Ранее раствор азотной кислоты применялся для повышения кислотности во время тонировки.
С помощью азотной кислоты осуществляют проверку содержания золота в сплаве. Если при капании на поверхность выделяется газ, это означает, что изделие ниже 583 пробы. Чем обильнее образование пузырьков, тем ниже концентрация золота.
Опасность и меры предосторожности
Азотная кислота крайне токсична, относится к 3 классу опасности. Смертельно ядовита при вдыхании, повреждает слизистую дыхательных путей. При контакте с кожей провоцирует пожелтение кожного покрова и возникновение язв. При работе с реагентом следует соблюдать меры безопасности, надевать защитные перчатки, респиратор и очки.
Перевозка, хранение
Хранят азотную кислоту в тёмной непрозрачной таре в прохладном вместе вдали от света. Транспортировку осуществляют в герметично закрытых полиэтиленовыми пробками хромированных либо алюминиевых ёмкостях.
Где купить, цена и производители
Как концентрированную азотную кислоту, так и разбавленную можно приобрести в специализированных магазинах химических реактивов. Цена 1 литра – от 750 рублей. Оптом она продаётся заводами-производителями по стоимости от 45 руб/кг при минимальной закупке – 40 кг. Основные производители азотной кислоты:
- компания «Полимер»;
- КИТАЙХИМПРОМ;
- «Урал-ОЦМ»;
- НПК «ОборонМетХим».
Заключение
Азотная кислота – это ценное вещество, применяемая во всех областях деятельности человека. В основном её применение распространяется на цели промышленной органики и неорганики, апробации золотых сплавов, поставки взрывчатки, лекарств, фунгицидов. Раствор азотной кислоты и её пары вредны для здоровья, при эксплуатации соединения нужно работать в защитной одежде. Бывает концентрированная азотная кислота и разбавленная.
Читайте также:



 (2 оценок, среднее: 4,50 из 5)
(2 оценок, среднее: 4,50 из 5)











Оставить комментарий