Угольная кислота – это органическое нестабильное соединение, быстро разлагающееся на углекислый газ и воду. В природе не встречается, может быть синтезировано в лабораторных условиях. Вещество применяется в промышленности в качестве реагента, для насыщения пузырьками питьевых жидкостей, в биохимии для идентификации ферментной реакции и контроля её хода в режиме реального времени. Угольная кислота необходима для производства морозильников, холодильных агентов, солнечных батарей.
Содержание
Что такое угольная кислота
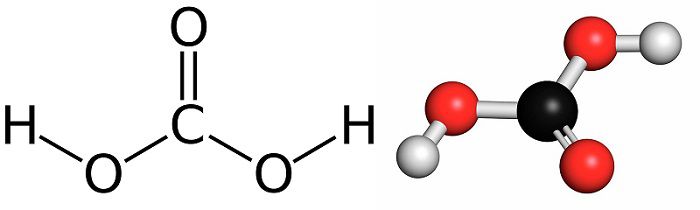
Угольная кислота представляет собой двухосновную карбоновую кислоту, имеющую пару гидроксильных группировок (-OH), присоединённых к углеродному атому. Формально она содержит карбоксильную группу -COOH. В природе углекислота не существует и моментально разлагается на оксид, синтезированная в вакууме в безводных условиях довольно стабильна и отличается высокими показателями устойчивости к агрессивным воздействиям окружающей среды.
Впервые угольную кислоту получил британский естествоиспытатель Джозеф Пристли в конце 18 века, растворив диоксид углерода в водной среде. После этого содовая получила широкое распространение и возникла необходимость в промышленной выработке ценного вещества.
Физические свойства, внешний вид, формула
Угольная кислота — это равновесный раствор, в котором преобладает разложение с образованием двуокиси углерода. Химическая формула кислоты – H2CO3. Молекула располагается в пространстве на плоскости. Положение отдельных функциональных частей описывается sp2– гибридизацией – перекрывание атомных орбиталей (область пребывания электрона, электронное облако) – sp и p. Sp2-разновидность предполагает накладывание p-орбиталей и одной sp, они направлены к вершине треугольника под углом 120 °.
Ангидрид имеет вид твёрдых кристаллов без цвета и запаха с характерным кисловатым вкусом. Переходит из твёрдого состояния в газообразное при -30 °С. Не подвержен ультрафиолетовому излучения, избыточной влажности при низких отрицательных температурах. При подогревании дестабилизируется, в дальнейшем отмечается термолиз.
Химические свойства, реакции
Растворы угольной кислоты реагируют с активными металлами щелочноземельного ряда и соответствующими гидроксидами, образуя карбонаты:
H2CO3 + Ca → CaCO3 + H2↑
Угольная кислота проявляет типичные для кислот свойства, взаимодействуя с основными оксидами. Оксид кальция переходит в соль угольной кислоты:
H2CO3 + CaO → CaCO3 + H2O
Схожие продукты наблюдаются при взаимодействии с гидроксидом кальция:
H2CO3 + Ca(OH)2 → CaCO3↓ + 2H2O
Угольная кислота реагирует с гидроксидами, давая начало бикарбонатам:
H2CO3 + NaOH → NaHCO3 + H2O
Реакция с гидроксидом может пойти и по другому пути, в результате выделяется карбонат:
H2CO3 + NaOH → Na2CO3 + H2O
Другие соли угольной кислы формируются при смешивании её растворов с карбонатами:
H2CO3 + CaСO3 → Ca(HCO3)2
Раствор угольной кислоты реагирует с силикатами, образуется осадок кремневой кислоты:
H2CO3 + Na2SiO3 → H2SiO3↓ + Na2CO3
Термолиз либо смешивание с жидкостью приводит к распадению, оксид улетучивается:
H2CO3 → CO2↑ + H2O
Диссоциация (расщепление на ионы) идёт в несколько обратимых этапов:
- H2CO3 → H+ + HCO3–
Первая ступень приводит к образованию протонов водорода и гидрокарбонат-иона, заряженного отрицательно.
- HCO3– → H+ + CO32-
Вторая, заключительная, стадия характеризуется образованием карбонат-иона, который имеет не поделённые электроны.
Индикатором произошедшей диссоциации служит покрасневшая лакмусовая бумажка. Посредством лакмуса – красящего пигмента, нанесённого на целлюлозу, известен в химии как pH-индикатор, краснеющий в кислой среде и синеющий – в щелочной. Высокая концентрация положительно заряженного водорода способствует закислению.
Получение, уравнение угольной кислоты
В лаборатории раствор угольной кислоты производится посредством растворения соответствующего оксида:
CO2 + H2O → CO2 ∙ H2O → H2CO3
Реально получение угольной кислоты из ее солей через добавление к ним более сильных кислот, металлы вытесняются, отделяется белёсый осадок, раствор мутнеет, образуется взвесь мелкодисперсных хлопьев:
Na2CO3 + 2HCl → 2NaCl + H2CO3↓
Поскольку в растворенной форме она не способна существовать долгое время, запускается реакция разложения.
В промышленных условиях получение ведётся, как правило, через низкопроцентные газы. Для этого используют соду, а также поташ, обработку гидроксидами. Протекает реакция обмена, формируется раствор угольной кислоты.
Применение
Угольная кислота нашла широкое применение в связи с быстрым распадом на составные элементы. Часто используется для обогащения пузырьками лимонадов. В тяжёлой промышленности выполняет роль охлаждающего наполнителя холодильных машин, в садоводстве применяется как эффективное удобрение, регулирующее углеводное питание растений. Необходима в альтернативной энергетике, основной ресурс которой – солнечное излучение. Важна для органического синтеза, с помощью свойства давления газов пропорционально смещающемуся водородному показателю (pH).
Применение в пищевой промышленности
Раствор угольной кислоты пригоден для изготовления газированных напитков, поскольку сам диоксид трудно растворим при механической газации. Ее можно встретить в составе такой продукции как:
- фруктовые и минеральные напитки;
- лимонады;
- искусственно газированные вина;
- алкоголь (шампанское);
Нередко насыщение ведут химическим способом, в результате реакции брожения углекислота выделяется микроорганизмами, дрожжами, бактериями. По свойствам она практически не отличается от синтетической, менее интенсивна. Ее встречают в следующих продуктах:
- хлебный квас;
- пиво;
- игристые вина;
- чайный гриб;
- сидр.
Угольная кислота не проявляет дезинфицирующих свойств, т.к. не подавляет рост и жизнедеятельность патогенной микрофлоры и грибков, не сдвигает показатель кислотности среды, не служит консервантом.
Применение в сельском хозяйстве и других сферах
Угольная кислота – качественное удобрение, восполняющие дефицит углерода в растительном организме. Оно необходимо на бедных, истощенных почвах. Подкармливать культуры, склонные к недостатку азота, углекислотой не следует, поскольку она ухудшает усвоение этого макроэлемента. Внесение его в почву приемлемо под такие растения:
- картофель;
- перцы;
- томаты;
- огурцы;
- плодовые деревья;
- декоративные цветы;
- ягодные кустарники: смородина, малина, крыжовник;
- виноград;
- клубника.
Возможно два способа удобрения: внекорневое и прикорневое. Первый метод заключается в опрыскивании листьев в разгар вегетации либо сбрызгивании взошедших ростков. Второй предполагает полив под корень. Удобрять желательно до завязывания плодов и цветения, весной, в начале осени. Угольная кислота оказывает мощное комплексное влияние на состояние растительности:
- Повышается прочность стеблей, побегов.
- Интенсифицируется иммунный ответ, устойчивость к насекомым-вредителям, грибковым заболеваниям.
- Ускоряется процесс формирования плодов, вкусовые качества становятся лучше за счёт накопления углеводов.
- Обеспечивает стойкое, яркое и продолжительное цветение.
- Улучшается засухоустойчивость, холодостойкость, ветроустойчивость.
Для получения наилучшего эффекта после применения угольной кислоты необходимо обильно рыхлить почву, создавая приток кислорода воздуха к корневой системе.
Угольная кислота — это предшественник многих ценных соединений. Она нужна для синтеза литиевой соли, востребованной для керамики и ракетных двигателей, многих гидроксидов. Сегодня распространены натуральные хладагенты, один из которых основан на производном углекислоты.
Где купить и сколько стоит
Угольная кислота продаётся заводами-производителями по цене от 70 рублей за 1 литр. Российских рынок чаще занимают зарубежные компании. Реактив можно приобрести в интернет-магазинах, специализирующихся на реагентах. Стоимость 100 мл порядка 300 рублей.
Заключение
Угольная кислота – это вещество, которое интенсивно разлагается при нагревании либо растворении. Активно используется для неорганического синтеза, биохимических исследований, в огородничестве для улучшения свойств почв и углеродного питания культурных растений. Является незаменимым компонентом керамопроизводства, пищевой индустрии, сталеварения, энергетической области.
Читайте также:















Оставить комментарий