Фосфин – это газ, который вырабатывается как промышленностью, так и в процессе жизнедеятельности организмов. Обладает целым рядом интересных свойств. Например, он является причиной суеверий, связанных с ночными огоньками на болотах, используется в исследовании космоса и является одной из причин глобального потепления. Фосфин – это ядовитый газ. Рассмотрим свойства фосфина, применение это газа, симптомы отравления и первую помощь.
Содержание
Что такое фосфин, формула вещества
Фосфин — это соединение фосфора и водорода. Химическая формула фосфина имеет вид:
PH3
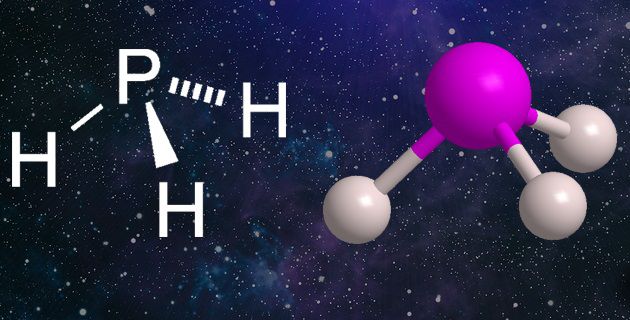
Как показывает формула фосфина, он состоит из трёх атомов водорода и одного атома фосфора. В природе встречается только в виде газа. В промышленных условиях может сжижаться и даже переходить в твёрдое состояние в виде кристаллов. Растворяется в воде, получается в ходе жизнедеятельности анаэробных бактерий, в некотором количестве выделяется из почвы.
Физические свойства фосфина, внешний вид
Рассмотрим подробно физические свойства фосфина:
- Молекулярная масса – 34.3;
- Плотность в нормальных условиях – 1.529 кг/м3
- Температура кристаллизации – 133.5°C;
- Температура плавления – 133.8°C;
- Переход в газ при температуре 87.5°C;
- Растворим в воде, крови. Предельная растворимость при 20°C составляет 27мл/100г.
- Горит. Минимальная концентрация самовозгорания около 26 г/л.
Молекула фосфина имеет форму тетраэдра, вершиной которого является молекула фосфора, и от неё отходят в одну сторону три молекулы водорода. Угол между водородными связями при этом составляет 93.5 градусов. Затвердевая, образует кубическую кристаллическую решётку. Обладает слабо выраженными щелочными свойствами как в водном растворе, так и в сжиженном виде. Растворим в диэтиловом эфире, сероуглероде, бензоле.
В чистом виде фосфин – это бесцветный газ, без выраженного запаха. Так как при промышленном получении обычно содержит ряд примесей, то его присутствие в воздухе можно определить, почувствовав запах тухлой рыбы, жареного чеснока, лука. Чистый и сухой фосфин не воспламеняется в обычной воздушной среде, такое возможно только при температуре выше 100°C. Однако при его образовании при взаимодействии соединений фосфора и воды в составе газа образуется значительная доля дифосфина, P2H2. Благодаря этой примеси он может самовоспламеняться при комнатной температуре.
Химические свойства фосфина
Рассмотрим химические свойства фосфина, как он взаимодействует с другими веществами.
Реакция горения фосфина:
2O2 + PH3 = H3PO4 + T или
2PH3 + 4O2 = P2O5 + 3H2O + T
При большой концентрации фосфина реакция идёт преимущественно по второму типу.
Реакция разложения фосфина при нагреве:
2PH3 + T = 2P + 3H2↑
Реакция фосфина с серной кислотой:
PH3 + 4H2SO4 (конц.)+ T =H3PO4+4SO2+H2O
Реакция проходит при температуре. Без нагрева образуется не ортофосфорная, а фосфористая кислота H3PO3.
Реакция фосфина с кислотой — проявление основных свойств, образование солей фосфония:
PH3 + HCl = PH4Cl
Соединение слабое, разлагается в присутствии воды. Является одной из форм хранения фосфина — реакция легко обратимая. Используется для хранения фосфина в целях фумигации — уничтожения насекомых в зернохранилищах.
Производство и получение фосфина
Получение фосфина в лабораторных условиях реакцией кислоты с дифосфидами металлов:
Mg3P2 + 6HCl + T = 3MgCl2 + 2PH3↑
Данная реакция относится к реакциям гидролиза. Вместо дифосфида магния может выступать другое соединение с щелочноземельными металлами, например, кальция. Во время реакции более электроотрицательные атомы хлора замещают ионы фосфора, которые, в свою очередь, соединяются с ионами водорода. При этом происходит еще и образование некоторого количества P2H2, упомянутого ранее.
Более сложная реакция – диспропорционирование, когда используемый белый фосфор выступает и в качестве окислителя, и в качестве восстановителя:
4P + 3KOH + 3H2O + T = 3KH2PO2 + PH3↑
Здесь электроположительный калий вступает в реакцию с фосфором и водой. Из-за своих выраженных щелочных свойств он образует гипофосфит, остатки фосфора вступают в реакцию с образовавшимися ионами водорода и выделяются в виде газа из раствора.
Получение фосфина в промышленности
В основном используется описанная выше реакция белого фосфора с горячей щёлочью. Еще применяется реакция восстановления фосфоновой кислоты:
H3PO3 + 3 Zn + 6HCl = PH3↑ + 3ZnCl2 + 3H2O
Применение фосфина
Применение фосфина в сельском хозяйстве как пестицида
Фосфин – это эффективный пестицид. Газ чрезвычайно ядовит и сильно воздействует на насекомых, которые вредят урожаю. Хорошо действует и на грызунов.
В чистом виде как газ из баллонов не используется. Чаще всего используется описанная выше реакция PH3 + HCl = PH4Cl в своём обратимом виде, разложение PH4Cl в присутствии воды. Также применяют реакцию воды с фосфидом магния. В результате её при взаимодействии с влагой из воздуха образуется фосфин. Выделение идёт достаточно активно.
P2Mg3 + 6H2O →2PH3 + 3Mg(OH)2
Резистентность и эффективность фосфина в качестве пестицида
У некоторых видов насекомых, в частности, у кожеедов, отмечается выработка резистентности к фосфину. У других видов она слабо выражена, повторные обработки бывают так же эффективны, как и первая. При борьбе с грызунами резистентности не отмечено. Однако отмечается, что большинство грызунов всё-таки в процессе обработки успевают выйти из опасной зоны и поражение их не затрагивает. В этом плане фосфин менее эффективен, чем яды, применяющиеся в составе приманок.
Влияние фосфина на продукты питания
По заключениям специалистов, применение фосфина в качестве пестицида или фумигатора никак не влияет на качество продуктов питания, которые им обработаны. Газ не оставляет каких-то ядовитых следов на поверхности плодов, зерна или в муке.
В космической науке
Считается, что пары фосфина в атмосфере могут появляться в результате деятельности анаэробных бактерий. Если в спектре излучения атмосферы телескопы находят такие следы, то это может свидетельствовать о наличии жизни.
Опасность фосфина, токсичность, меры предосторожности
Фосфин – это сильный яд нервно-паралитического действия. При работе с ним необходимо соблюдать меры предосторожности:
- Использовать противогаз со специальной гильзой, предназначенной для работы с фосфином;
- Одевать костюм химической защиты;
- Применять защитные перчатки.
Нельзя находиться в помещении, где проходит обработка фосфином. При наличии симптомов отравления необходимо оказать помощь.
Симптомы отравления фосфином и первая помощь
Симптомами отравления являются:
- В лёгких случаях: тошнота, головокружение, боль в области диафрагмы и средней части спины;
- В тяжёлых случаях: головокружение, сильная головная боль, конвульсии, потеря сознания.
При обнаружении симптомов отравления фосфином первая помощь при отравлении состоит в том, чтобы человек покинул зону обработки, затем немедленно вызывают врача. При наличии сознания и пульса необходимо его освободить от одежды и уложить — иногда одежда содержит в складках газ, который можно вдохнуть. При отсутствии сознания и наличии пульса пострадавшего выносят из зоны поражения, раздевают и укладывают в горизонтальное положение. При отсутствии пульса проводят реанимацию до приезда врача.
Где купить и сколько стоит
В небольшом количестве его легче всего приобрести в специализированных магазинах в виде таблеток фосфида магния. Они при реакции с влагой выделяют газ фосфин. Возможна продажа таблеток фосфида алюминия, они менее интенсивно выделяют фосфин при реакции с водой, но достаточно для нормальной обработки помещения. Цена за 1 килограмм таблеток — около 2500-3000 рублей, при оптовой закупке цена существенно ниже.
Заключение
Фосфин – это вещество, которое нашло основное применение в сельском хозяйстве, а также некоторых областях науки. Некоторые исследователи считают, что его выделение на болотах в России в связи с глобальным потеплением и таянием вечной мерзлоты способно сильно ускорить эти процессы. При обращении с ним нужно соблюдать осторожность — это сильный и опасный яд.
Читайте также:















Оставить комментарий