Сульфат натрия – это неорганическое соединение, сернокислая соль натрия. Вещество применяется во многих сферах. В пищевой промышленности зарегистрирована, как пищевая добавка Е514, относится к классу эмульгаторов и стабилизаторов, является регулятором кислотности среды. Активно применяется в химической промышленности, при производстве моющих средств, стиральных порошков, используется как осушитель в лабораторных условиях. Вещество обладает слабым слабительным действием, поэтому на его основе создают препараты для очищения кишечника при запорах.
Содержание
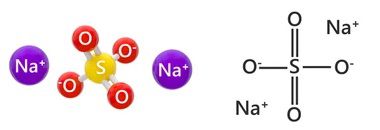
Что такое сульфат натрия, формула
Сульфат натрия – это натриевая соль серной кислоты – среднюю соль, включающую натрий (Na+) и кислотный остаток (SO42-). Химическая формула вещества:
Na2SO4
Атомы соединены ионной связью.
Безводный сульфат натрия можно найти в природе в виду тенардита – минерала, состоящего из оксида натрия (Na2O) и ангидрида серной кислоты (SO3) в процентном соотношении 43,7 % и 56,3%. Кристаллы таблитчатой формы, бесцветные, иногда беловатые, желтоватые, серые или отливают коричневым. Обладают стеклянным блеском, иногда более ярким, жирным, высоко прозрачные, иногда с красноватым отблеском. Нетвёрдые, твёрдость по шкале Мооса 2-3, хрупкие, рассыпчатые. Тенардит проявляет высокую гигроскопичность, содержит примеси брома, калия, хрома. Минерал в комнатных условиях поглощает влагу из воздуха, покрываясь белой коркой кристаллогидрата сульфата натрия. При длительном хранении рассыпается в порошок.
Месторождения распространены в Казахстане, на Урале, в Челябинской области, в США, в частности в штате Калифорния. Встречается минерал в глубине гор, выпадает на дне усыхающих солёных озёр.
Обводнённые соединения натриевой соли серной кислоты в природе встречаются в виде мирабилитов: Na2SO4 · H2O. Декагидрат по химическому составу содержит Na2O – 19,3%, SO3 – 24,8 %, H2O – 55,9%. Глауберова соль представляет собой соединение коротких волокнистых кристаллов, имеющих призматическую форму. Кристаллы белого цвета с матовым блеском, прозрачные, отличаются низкой плотностью и крайне низкой твёрдостью по шкале Мооса – 1,5, это один из самых лёгких минералов в мире.
Основные месторождения глауберовой соли находятся на территории Канады, Грузии, Туркмении. Встречается он также в Германии, Чехии. В России распространён в Западной Сибири, а также в Астраханской области. Залежи обнаруживают, как правило, в морской воде, минеральных водах, солёных озёрах.
В природе сульфат натрия можно встретить в составе минералов двойных солей:
- астраханит – комплекс водного сульфата натрия и магния Na2SO4 MgSO4 · 4H2O;
- глауберит – соединение сульфата натрия и кальция Na2SO4 CaSO4.
В чистом виде сульфат натрия имеет вид бесцветных кристаллов низкой плотности, без запаха, но с характерным горько-солёным вкусом. Иногда может быть порошкообразным, с беловатым или сероватым цветом. Хорошо растворяется в воде, при этом происходит выделение тепла, реакция растворения экзотермическая. Не растворим в органических растворителях, в том числе в спирте. При повышении температуры окружающей среды до +32 °С начинает поглощать воду из воздуха, образуя кристаллогидрат, водную соль.
Реакции с сульфатом натрия и химические свойства
Химические свойства вещества обусловлены наличием щелочноземельного металла в составе, проявляющего основные свойства, а также группировкой, представленной остатком серной кислоты. Способен вступать в реакцию с фтором:
Na2SO4 + F2 → 2NaF + SO2F2 + O2↑
Реакция протекает при нагревании до 120 °С, при этом выделяется кислород, образуется фторид натрия и оксофторид серы. Из простых соединений сернокислый натрий вступает в реакцию с водородом с выделением воды и сульфида натрия:
Na2SO4 + 4H2 → Na2S + 4H2O
Из сложных веществ сульфат натрия вступает в реакцию с гидроксидом бария, образуя едкий натр, а также сульфат бария в виде осадка белого цвета:
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
В твёрдом виде сульфат натрия реагирует с серной кислотой, формируется комплексная кислая соль, гидросульфат натрия:
Na2SO4 + H2SO4 → 2NaHSO4
В ходе реакции происходит образование метабисульфита натрия. Сульфат натрия вступает во взаимодействие с другими солями, в частности с хлоридами:
Na2SO4 + BaCl2 → BaSO4↓ + NaCl
Нерастворимая соль бария выпадает в осадок, образуется поваренная соль. Данная реакция является качественной, индикаторной для определения наличия сульфатов в растворе.
Получение и производство
В лабораторных условиях сульфат натрия получают путём различных химических реакций. Его синтезируют с помощью приливания к серной кислоте едкой щёлочи:
H2SO4 + 2NaOH → Na2SO4 + H2O
Другой способ заключается в нагревании среды до 600-700 °С, при котором производят сплавление бисульфата натрия с хлоридом натрия:
NaHSO4 + NaCl → Na2SO4 + HCl
Побочным продуктом реакции является соляная кислота. При добавлении к твёрдому хлориду натрия серной кислоты в условиях кипения также формируется сульфат натрия, но хлороводород выделяется в виде паров:
2NaCl + H2SO4 → Na2SO4 + 2HCl↑
При нагревании кристаллического сульфида натрия в кислородной среде до 400 °С можно получить сульфат натрия
Na2S + O2 → Na2SO4↓
Реакция обработки сульфида натрия концентрированной перекисью водорода:
Na2S + 4H2O2 → Na2SO4+ 4H2O
В промышленности применят добычу сульфата из природного сырья: минералов тенардита, астраханита, глауберита, мирабилита. При этом используется технология выпаривания и плавления. В реактор поступает сырьё, которое плавят при температуре 60 °С. Расплавленный раствор содержит молекулы сульфата натрия, он поступает на центрифугирование (разделение на составные части), а затем в выпариватель, где высушивается. Затем происходит многократная кристаллизация до очищения вещества.
Другой способ – получение сернокислого натрия из раствора расплавленного минерала путём внесения в него солей-реагентов. Процесс состоит из нескольких этапов:
- Плавление минерала в реакторе.
- В раствор вносят высаливающие агенты: поваренная соль или другие смешанные соли. Температура на этом этапе составляет порядка 60-65 °С.
- Жидкость сгущают.
- Масса поступает в фильтраторы, где побочные продукты отфильтровываются и сбрасываются.
- Раствор промывается и поступает на центрифугу.
- Центрифугированная часть подаются в сушилки, где кристаллизуется и лишается влаги. На выходе получается готовый продукт.
Ранее в промышленности применяли сплавление хлорида натрия с серной кислотой при температуре свыше 600 °С в специализированных «сульфатных печах». Сегодня методика практически не используется, т.к. отличается излишней дороговизной, сложностью в обслуживании и контроле, сопряжена с работой с опасными реагентами – серной и соляной кислотами. Минерального сырья достаточно для насыщения рынка сульфатом натрия.
Полезные свойства
Сульфат натрия полезен для организма, поскольку благоприятно воздействует на желудочно-кишечный тракт. Соль хорошо всасывается и усваивается, она раздражает гладкую мускулатуру кишечника, стимулируя сократительную активность. Это необходимо при атонии кишки, когда сокращений недостаточно для проталкивания пищевого комка и каловых масс. Сернокислый натрий оказывает влияние на осмотическое давление в полоски кишечника, он вытягивает воду, т.к. обладает высокой гигроскопичностью. За счёт этого кал становится менее твёрдым, облегчается дефекация при запорах.
Раствор сульфата натрия в воде применяют для детоксикации при отравлении солями бария. Попадая в желудок, происходит взаимодействие между веществами, натриевая соль серной кислоты нейтрализует соли бария.
Вещество применяют при производстве смесей для промывания носа наряду с другими солями. Оно вытягивает слизь, способствуя увлажнению носовой полости и удалению болезнетворных микроорганизмов.
Вред
Сульфат натрия может быть опасным при превышении допустимых дозировок употребления. При проглатывании большого количества данной соли появляется тошнота, диарея, головокружение, снижение артериального давления, а также боли в животе.
При соблюдении инструкции по применению препараты на основе сернокислого натрия не наносят вреда организму. В составе продуктов питания пищевая добавка Е514 находится в очень малых количествах, поэтому никак не влияет на здоровье.
Применение
Сульфат натрия применяется в различных сферах. В производстве продуктов питания пищевая добавка Е514 используется в качестве антиокислителя, эмульгатора и антислёживающего агента. В косметологии и химической промышленности вещество применяется для увеличения пенности и улучшения очищающих свойств. Широкое применение соль нашла в стекольном производстве, цветной металлургии, текстильной и кожевенной промышленности. Сернокислый натрий используется в медицине как слабительное и промывающее средство.
Применение сульфата натрия в пищевой промышленности
В пищевой отрасли добавка Е514 проявляет свойства регулирования кислотного состава среды. Она предотвращает закисление продукта, стабилизирует водородный показатель. Вещество применяется как эмульгатор. Внесение его в состав обеспечивает формирование стабильной, не расслаивающееся структуры. Благодаря сульфату натрия можно смешивать трудносовмещаемые продукты. Из-за неприятного солоноватого вкуса применение пищевой добавки ограничено.
Применение сульфата натрия в косметологии и химической промышленности
В косметологии сульфат натрия применяется для стабилизации структуры кремов и масок, а также для нормализации водородного показателя интимного мыла, средств для умывания для нежной кожи. С помощью внесения добавки можно контролировать кислотность косметики.
В шампунях сернокислый натрий усиливает пенообразование, способствует бережному очищению волос и кожи головы. Не провоцирует выпадение волос, а также аллергии и появления перхоти.
В химической промышленности сульфат натрия – это распространённое вещетво, необходимое для осушения растворов. Оно эффективно и быстро впитывает излишки воды. Натриевая соль серной кислоты также является компонентом стиральных порошков и моющей продукции. В растворе она усиливает действие поверхностно-активных веществ, повышая отстирывающую и отбеливающую способность порошка. При этом она не выпадает в осадок, не формирует нерастворимых комочков и не окрашивает одежду.
Сульфат натрия – это незаменимый компонент в процессе производства сульфатной целлюлозы. Большинство производимой в мире целлюлозы выпускается с помощью обработки сульфатами. В стекловарении сернокислый натрий осветляет стекло, делает его более гладким и прозрачным.
Применение сульфата натрия в медицине
Сульфат натрия входит в состав слабительных средств и антидотов. Его применяют при следующих клинических состояниях:
- хронические запоры;
- отравление тяжёлыми металлами;
- интоксикация солями бария;
- пищевые отравления;
- в составе комплексной антипаразитарной терапии.
Благодаря способности натриевой соли серной кислоты к стимуляции гладкой мускулатуры кишечника происходит мягкое устранение запоров. Физиологических механизм связан с повышением осмотического давления при постепенном всасывании в кишечнике и насыщении цитоплазмы клеток солью. Эффект после приёма слабительного наблюдается через четыре часа.
Сульфат натрия – это компонент порошка для промывания носовых проходов. В состав входит несколько видов солей, в том числе хлорид натрия. Горький вкус вещества при этом не имеет значения, поэтому оно может использоваться без ограничений. Сульфат абсорбирует молекулы воды, происходит отделение лишней слизи, с которой удаляются бактерии и погибшие иммунные клетки.
Тип пищевой добавки, класс опасности и токсичности, хранение
Пищевая добавка Е514 относится к эмульгаторам, стабилизаторам и антислёживающим агентам. Она также применяется как антиокислитель. Сульфат натрия относится к 4 классу опасности – малоопасные вещества. Не токсичен для организма при приёме допустимых доз, при передозировке вызывает тошноту, рвоту, боль в животе, гипотонию, головокружение.
Пищевая добавка Е514 необходимо хранить при температуре не выше +25 °С, в помещении с влажностью, не превышающей 50%, в герметично закрытой таре, в месте, недоступным для солнечного света. Комната для хранения должна быть вентилируемой. Температурный режим воздуха не должен опускаться ниже 0 °С. Срок годности составляет 3 года с даты изготовления.
Где купить и сколько стоит
Сернокислый натрий продаётся заводами-производителями и отличается низкой стоимостью. Цена 1 кг добавки составляет от 17 до 125 рублей. Фирмы продают вещество оптом от 25 кг. Препараты сульфата натрия продаются в аптеке, стоит порядка 80-90 рублей.
Заключение
Сульфат натрия – это неорганическая натриевая соль серной кислоты. Она добывается из природных минералов и применяется во многих сферах. Основная сфера применения – химическая промышленность, вещество вносят в состав стиральных порошков, моющих средств. Вещество применяют в качестве осушающего реагента, для осветления стекла. В медицине сульфат натрия – это слабительное и антитоксическое средство, в пищевой промышленности Е515 применяется для регуляции кислотности продуктов, предотвращения слёживания, образования комочков.
Читайте также:















Оставить комментарий